Im dritten Teil dieser Beitragsserie zur Einführung in die Spektroskopie will hier hier für die ganz Interessierten nochmal kurz auf die im zweiten Teil schon angerissenen Fragen eingehen:
Was sieht man in einem Spektrum eigentlich, und was hat das mit chemischen Elementen zu tun?
Und wie schon im vorherigen Teil werde ich versuchen, das möglichst einfach darzustellen. Auch hier gilt – das ist alles aus der Sicht und mit dem Wissen eines Einsteigers geschrieben und mag daher in einigen Details nicht vollkommen korrekt sein. Die wesentlichen Zusammenhänge sollten aber richtig wiedergegeben sein.
Um das grundsätzlich zu verstehen müssen wir einen Blick auf die Atome, genauer gesagt auf deren Elektronen werfen. Fast jeder weiß ja, dass Elektronen den Atomkern umgeben. Man kann sich das (stark vereinfacht!) vorstellen wie Satelliten, die einen Planeten umkreisen. Im Gegensatz zu einem Satelliten sind einem Elektron aber nicht alle beliebigen Bahnhöhen möglich. Sie können sich nur auf genau definierten Bahnhöhen bewegen und um dies zu tun, benötigen sie wiederum eine dazu passende Energie.
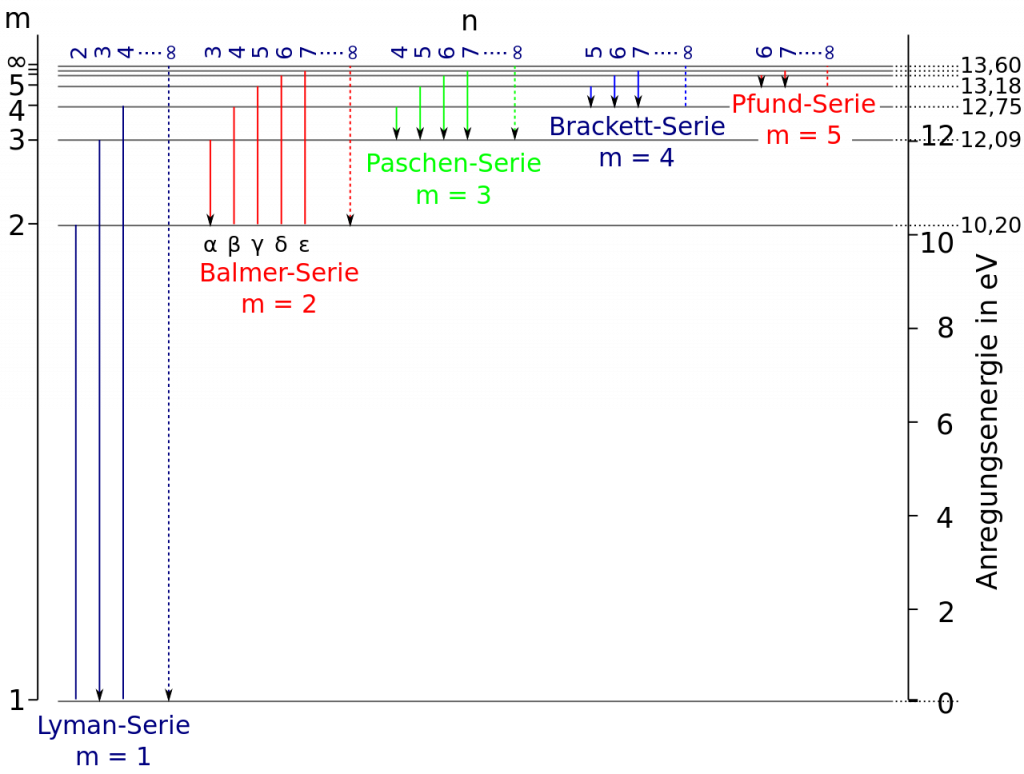
Die Elektronen können zwischen diesen Bahnen wechseln, z. B. auf eine höhere Bahn springen. Dazu benötigen sie aber eine exakt passende Energiemenge, die von außen zugeführt werden muss. Sie können von diesen höheren Bahnen auch auf niedrigere zurückfallen. Dabei wird dann Energie frei, die in Form von Licht (also einem Photon) abgestrahlt wird. Die untenstehende Abbildung zeigt am Beispiel des Wasserstoffatoms diese verschiedenen möglichen Bahnen und die Übergänge dazwischen. Man spricht hier auch von Energiezuständen bzw. Energieniveaus des Elektrons.
Die Anregung, d. h. die Energiezufuhr von außen, kann z. B. ebenfalls durch Photonen, also Licht erfolgen. Trifft ein Photon ein Elektron, überträgt es seine Energie und kann das Elektron damit auf eine höhere Bahn, bzw. ein höheres Energieniveau bringen. Das Photon muss allerdings eine genau passende Energie besitzen, damit dieser Sprung gelingt. Diese Energie wiederum entspricht einer bestimmten Wellenlänge des Lichts. Eine hohe Energie entspricht dabei einer hohen Frequenz des Lichts und damit einer kurzen Wellenlänge. Ultraviolettes Licht ist also Energiereicher als Infrarotes. Das Photon wird bei diesem Energietransfer quasi „verschluckt“.
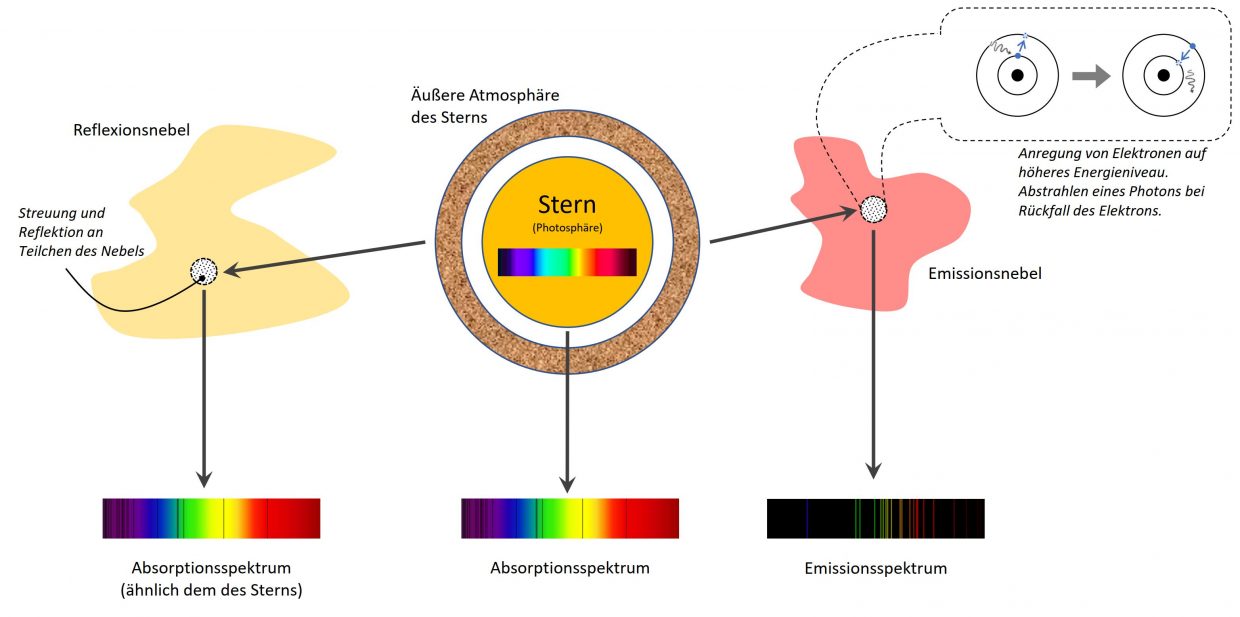
Strahlt nun Licht durch ein Gas, z. B. Wasserstoff, werden dabei all die Photonen mit einer „passenden“ Wellenlänge verschluckt, da diese mit Elektronen zusammenstoßen und sie dabei auf eine höhere Bahn bringen können. Bekanntlich entspricht jede Wellenlänge einer bestimmten Farbe und eben diese Farben fehlen nun also, wenn das Licht nach seinem Weg durch das Gas in ein Spektrum zerlegt wird. Es entsteht ein Absorptions-Spektrum.
Das passiert z. B. immer dann, wenn das Licht aus der Photosphäre eines Sterns (das erstmal alle Wellenlängen enthält) durch die darüber liegenden Schichten der Sternatmosphäre strahlt. Welches Muster diese Lücken im Spektrum haben hängt von der Art des Elements ab und davon, welche „Sprünge“ seinen Elektronen möglich sind. Ja nach dem, wieviel Energie so ein Sprung braucht treten sie an verschiedenen Stellen im Spektrum auf. Daher verrät uns ein Spektrum des Sterns, welche Elemente seine Atmosphäre enthält. Bei der Sonne kennt man das als Fraunhofer-Linien, bei Altair haben wir das eben als deutliche Absorptionslinien des Wasserstoffs gesehen.
Bei Wasserstoff sind im Wesentlichen diese Linien der sog. Balmer-Serie bekannt, die sehr prägnant sind. Warum sehen wir aber die Linien der anderen möglichen Übergange bzw. Serien nicht (Paschen, Lyman, Brackett und Pfund)? Auch das hängt mit den Energien zusammen, die diese Bahnübergänge benötigen. Bei der Lyman Serie sind die nötigen Energien sehr hoch, die zugehörigen Frequenzen liegen daher ebenfalls sehr hoch, was extrem kleinen Wellenlängen entspricht. Daher liegen die Linien der Lyman Serie im nicht sichtbaren UV-Bereich des Spektrums. Genau anders verhält es sich bei den Linien der Pfund und Brackett-Serie. Hier sind die Energien sehr gering, entsprechend findet man sie weit im (ebenfalls nicht sichtbaren) Infraroten.
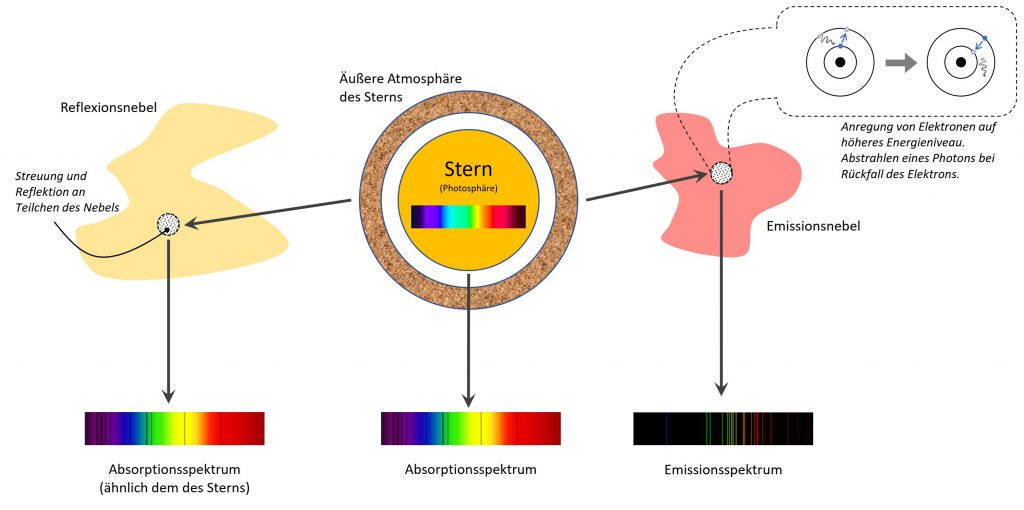
In interstellarem Gas, dass durch externe Quellen angeregt wird (das ist oft sehr energiereiche Strahlung eines benachbarten jungen und sehr heißen Sterns), passiert genau dasselbe. Elektronen werden „angehoben“ fallen zu rück und geben dabei die Energie des Elektrons als Licht einer bestimmten Wellenlänge ab. Dadurch entsteht dann ein Emissions-Spektrum.

Auf diese Weise leuchten dann auch viele der Nebel, die wir so gerne auf Deep-Sky Aufnahmen bewundern. Und das erklärt auch, weshalb Astrofotografen bei diesen Nebeln so gerne mit Schmalbandfiltern arbeiten. Diese lassen nur Licht einer bestimmten Wellenlänge passieren. Bei Wasserstoff ist der „Sprung“ zw. Niveau 2 u. 3 wg. der niedrigen erforderlichen Energie sehr häufig, weshalb die zugehörige sog. H-alpha Linie sehr ausgeprägt ist. Sie liegt bei 6563A im sichtbaren roten Bereich. So leuchten dann auch viele Nebel im rötlichen Licht eben dieser Linie.
Die Filter sind ausgelegt auf die stärksten Emissionslinien typischer Elemente in diesen Nebeln. Daher sind sie auch nach diesen Linien benannt, also z. B. H-alpha, OIII,… Entsprechend sinnlos sind diese Filter dann auch bei Sternen, wie ihr jetzt sicher versteht.
An dieser Stelle könnte man natürlich fragen, warum dieses Zurückfallen der Elektronen und damit das Abstrahlen von Licht der entsprechenden Wellenlänge nicht auch in der äußeren Atmosphäre eines Sterns auftritt? Denn tatsächlich verharren die Elektronen nur für extrem kurze Zeiten in ihrem angeregten Zustand (im Bereich einiger Nanosekunden). Demnach dürften diese Lücken im Spektrum ja gar nicht entstehen? Ich habe dazu bisher wenig Quellen gefunden, aber anhand dessen, was ich gelesen habe, lässt sich das folgendermaßen erklären.
Der Gedanke ist grundsätzlich schon richtig allerdings vernachlässigt er einen wichtigen Umstand. Denn das Licht, dass beim Zurückfallen von Elektronen auf ein niederigeres Energieniveau entsteht, wird diffus, d. h. in alle möglichen Raumrichtungen abgestrahlt. Zahlenmäßig entstehen dabei also weniger Photonen, die sich in Richtung auf unser Teleskop bewegen, als vorher bei der Anregung eines Elektrons „verschluckt“ werden. Blickt man mit seinem Spektroskop nicht auf die Sonnenscheibe selbst sondern leicht seitlich daneben auf ihre Atmosphäre, wird man auch tatsächlich wieder eine Emissionsspektrum erkennen. Denn aus der Atmosphäre können nur Photonen zu uns gelangen, die beim Zurückfallen der Elektronen auf ein niedrigeres Energieniveau entstanden sind. Aber eben kein direktes Licht aus der Photosphäre, denn auf die schaut unser Spektroskop ja auch nicht.
Neben den Emissionsnebeln gibt es noch die Reflexionsnebel. Diese Leuchten, weil sie Licht eines benachbarten Sterns reflektieren. Entsprechend ist ihr Spektrum auch dem des Sterns sehr ähnlich. Weil sie daher keine deutlichen Emissionlini0ne aufweisen, sind die oben genannten Filter bei diesen Nebeln ebenfalls nicht sehr hilfreich.
Soweit dieser kurze Ausritt in die Physik der Entstehung von Spektren. Wie gesagt, alles sehr gekürzt und vereinfacht. Aber ich hoffe, es hat ein wenig Licht in die „dunkle Materie“ der Spektren gebracht. 😉